Choc hémorragique
Le choc hémorragique d’origine traumatique est un choc fréquent, à l’origine d’une mortalité importante. L’attitude thérapeutique est basée sur une réanimation rapide dès la phase préhospitalière poursuivie en hospitalier avec stratégie d’hémostase chirurgicale, éventuellement radiologie interventionnelle dans certaines situations.
Les chocs traumatiques sont en Europe principalement dûs aux accidents de la voie publique, alors qu’aux Etats-Unis, une part non négligeable concerne les plaies par arme blanche ou arme à feu.
Les chocs hémorragiques non traumatiques restent assez rares, ou n’ont pas le temps d’être pris en charge dans une population médicale avancée en âge et pour laquelle les traitements qui auraient permis d’éviter cette situation n’ont pu être réalisés devant le risque majeur (ruptures aortiques, rupture de varices oesophagiennes, …). L’étiologie la plus redoutée chez la femme en période d’activité génitale reste la rupture d’une grossesse extra-utérine ainsi que les hémorragies pendant la grossesse.
Physiopathologie
Le choc est défini par un état pathologique au cours duquel le système circulatoire est incapable d’assurer une perfusion tissulaire suffisante pour répondre à la demande en oxygène de l’organisme.. C’est une inadéquation entre une demande accrue en oxygène cellulaire et un apport insuffisant, secondaire à une insuffisance circulatoire aiguë provoquant une diminution du transport en oxygène. La constatation la plus nette du choc est celle d’une hypotension persistante, inférieure à 90 mm Hg de PA systolique malgré épreuve de remplissage.
La physiopathologie précise est assez complexe et fait intervenir différents paramètres : baroréflexe, effet sympathomimétique, dysfonction microcirculatoire, cascade inflammatoire, coagulopathie …
La stimulation sympathique permet de conserver une certaine pression artérielle au début du choc par vasoconstriction artériolaire et veineuse, réaction adrénergique et réaction neurohormonale (activité rénine plasmatique et angiotensine II). Elle induit aussi la tachycardie qui maintient la PA.
La baisse de la précharge diminue le volume d’éjection systolique entraine une tendance à la baisse de la PA systolique mais la PA diastolique est maintenue, ce qui explique la diminution du rapport PAS – PAD ou PA différentielle.
Diagnostic
Positif
Le diagnostic est clinique, l’apparition des signes témoigne d’une spoliation sanguine de 30 à 40% du volume sanguin soit 1500 ml chez un sujet de 60 kg..
Le 1er critère classique du choc est l’hypotension artérielle mais ce signe peut être d’apparition ou de reconnaissance tardive et donc être à ce moment là un signe de gravité. D’autres causes en contexte traumatique peuvent fournir une hypotension sans qu’il y ait hémorragie active : il s’agit du syndrome vagal lié à la douleur et au stress du traumatisme (mais répétitif il peut témoigner d’un choc hémorragique) et du choc neurogénique des traumatismes crâniens et médullaires. La chute de la pression artérielle peut aussi être difficile à interpréter chez un hypertendu. En équivalent initial on peut avoir une hypotension orthostatique mais elle n’est que rarement recherchée.
En fait le 1er critère devrait être celui de la tachycardie : tachycardie sinusale ou apparition d’une fibrillation auriculaire paroxystique ou accélération d’une FA chronique, qui est bien plus précoce. Pareil il peut être difficile de l’interpréter chez un sujet sous antiarythmiques (bétabloquants, inhibiteurs calciques bradycardisants, amiodarone, digitaliques …). d’une manière général le choc est plus difficile à interpréter chez les sujets âgés.
Le faciès d’un patient en état de choc est parfois difficile à décrire pour les intervenants en termes médicaux clairs, mais la reconnaissance d’un malade qui va mal ou par euphémisme « qui ne va pas bien (du tout) » par un soignant concerné (et pas un jem’enfoutiste) ne pose en général pas trop de problèmes. Même si la présentation d’un patient choqué est moins impressionnante que celle d’une détresse respiratoire.
Les signes subjectifs classiques exprimés par le patient conscient sont le malaise répété, la soif, les vertiges et troubles neurosoriels visuels et auditifs, l’anxiété, la sensation de mort imminente.
Les signes physiques :
- cardiovasculaires
- pression artérielle conservée au début (choc compensé) puis pincement de la différentielle, puis collapsus PAS < 90 mmHg ou baisse > 30 mmHg par rapport aux chiffres habituels de l’hypertendu
- tachycardie et pouls filant mais bradycardie paradoxale possible en signe d’extrême gravité précédant l’arrêt cardiaque par désamorçage de la pompe cardiaque
- veines plates, en particulier jugulaires, qui peut faire virer au cauchemar la pose d’accès veineux périphérique
- respiratoires
- polypnée et tachypnée précoces
- tirage et signes de lutte
- cyanose tardive
- bradypnée paradoxale, pauses respiratoires, gasps
- neurologiques : confusion avec agitation jusqu’au coma
- néphro-urinaires : oligo-anurie avec urines foncées hyperconcentrées
- cutanés
- temps de recoloration cutané allongé > 2 s
- pâleur mais souvent tardif (lit de l’ongle, conjonctives, lobe de l’oreille)
- froideur des extrémités se généralisant à l’ensemble des téguments
- sueurs
- marbrures des extrémités, des genoux puis de l’ensemble des membres inférieurs mais elles sont assez rares dans le choc hémorragique (beaucoup plus fréquentes en choc distributif septique, mais aussi dans certains chocs cardiogéniques)
- purpura par coagulopathie de consommation
Le recueil des antécédents est important, en particulier au niveau digestif, vasculaire, respiratoire, tumoral et hématologiques, ainsi que les traitements en cours (anticoagulants en 1er lieu).
On peut schématiquement classer le choc en 4 stades en fonction de la spoliation sanguine :
| compensé | léger | modéré | sévère | |
| perte sanguine ml | < 1000 | 1000-1500 | 1500-2000 | > 2000 |
| fréquence cardiaque | < 100 | > 100 | > 120 | > 140 |
| pression artérielle | normale | hypotension orthostatique | baisse marquée | baisse importante |
| recoloration capillaire | normale | possiblement prolongée | prolongée | toujours prolongée |
| respiration | normale | modérément augmentée | tachypnée modérée | tachypnée sévère/collapsus respiratoire |
| diurèse horaire ml | > 30 | 20-30 | 5-20 | anurie |
| statut mental | normal/agitation | agitation | confusion | léthargie |
Le meilleur signe de correction du choc est la reprise de la diurèse.
Les complications sont l’insuffisance rénale, l’hyperkaliémie, l’acidose métabolique lactique, l’hypocalcémie liée aux remplissage et HEA, la CIVD, la défaillance multiviscérale, le choc cardiogénique par ischémie coronaire, le choc septique par translocation bactérienne, l’adiastolie par compression extrinsèque, et au final l’arrêt cardiaque.
Différentiel
- choc hypovolémique non hémorragique : déshydratation par pertes rénales, digestives, 3ème secteur (occlusion, pancréatite, …), cutanées
- choc obstructif : tamponnade, embolie pulmonaire massive, pneumothorax suffocant et emphysème médiastinal
- choc cardiogénique
- choc distributif : choc septique et choc anaphylactique
- choc spinal neurogénique
Examens paracliniques
Il n’y a pas besoin de test pour diagnostiquer le choc hémorragique quand l’hémorragie est extériorisée ou que le contexte est connu à risque d’hémorragie interne. Le monitorage initial est fondamental, les paramètres de mesure sont quasiment toujours perturbés : TA imprenable, SaO2 faussement effondrée sans détresse respiratoire évidente, température corporelle abaissée.
Le chiffre d’hémoglobine obtenu rapidement par test minute type Hemocue® est utile pour le suivi des variations de l’Hb, alors que la numération standard va mettre du temps à revenir. L’hémoglobine par dispositif rapide comme celle du laboratoire ainsi que l’hématocrite peuvent être normaux à la phase initiale. L’Hemocue est assez critiqué pour l’évaluation du choc hémorragique traumatique en préhospitalier, manquant de fiabilité puisque les pertes aiguës associent des pertes globulaires mais aussi de plasma, la concentration est ainsi faussée.
Le suivi des lactates artériels est un marqueur de souffrance tissulaire par hypoperfusion.
Un bilan biologique standard est souvent prélevé avec bilan de coagulation et β-HCG chez la femme en âge de procréer.
Les autres examens sont envisageables pour l’étiologie précise de la source du saignement, soit qu’elle ne soit pas connue avec précision, soit que les sources puissent être multiples. En fonction de la stabilité du patient, les plus simples sont la radiographie thoracique et l’échographie d’urgence FAST en salle de déchocage. Secondairement un scanner parfois corps entier peut être envisagé pour le bilan exhaustif des lésions (surtout polytraumatisé), sinon c’est l’acheminement rapide au bloc opératoire pour la stabilisation chirurgicale des lésions.
L’échocardiographie rapide permet selon certains protocoles type RUSH de comprendre le mécanisme du choc si celui-ci n’est pas évident. Elle permet surtout de distinguer rapidement un choc obstructif par obstacle à l’éjection, d’un choc cardiogénique. Dans le choc hémorragique ou hypovolémique, elle visualise un coeur hyperkinétique avec aspect d’augmentation de la fraction d’éjection pour pomper plus de sang et plus rapidement afin de compenser l’insuffisance circulatoire. Elle ne fait pas la différence cependant avec les chocs distributifs (septique et anaphylactique).
Les grandes hémorragies internes ne sont pas forcément faciles à reconnaître cliniquement, même si l’abdomen se défend généralement en cas d’épanchement péritonéal (sauf évidemment si le patient est déjà sous sédation). L’écho FAST permet de voir immédiatement hémopéritoine, hémothorax.
L’ECG est systématique pour le diagnostic différentiel et pour rechercher des signes d’insuffisance coronarienne secondaire à l’hypoxie.
Le sondage gastrique était conseillé devant tout état de choc inexpliqué à la recherche d’une hémorragie digestive.
Etiologies
Choc hémorragique d’origine traumatique
- Polytraumatisme
- traumatisme thoracique grave : hémothorax actif, rupture aortique
- traumatisme abdominal grave : rupture du foie, de la rate, lésions vasculaires notamment rétropéritonéales aortiques, hémopéritoine
- fractures du bassin
- lésions multiples des membres inférieurs, lésions d’écrasement (crush injury et crush syndrome), , fracture du fémur déplacée ou comminutive avec constitution d’un hématome extensible, dont amputation traumatique
- traumatisme facial complexe avec epistaxis, saignement oral, plaie du visage
- plaie du scalp étendue
- plaie délabrante avec perte de substance étendue
- plaie d’un axe vasculaire majeur : carotidien, sous-clavier, huméral, fémoral, poplitée
- spoliation sanguine modérée mais répercussion hémodynamique immédiate : tamponnade , hématome cérébral, extra-dural, sous-dural ou médullaire
- A titre indicatif les pertes sanguines prévisibles chez le traumatisé grave :
- scalp : 200 à 2000 ml
- fracture de vertèbre : 200 ml
- fracture de cote simple : 200 ml
- hémothorax : 500 à 2000 ml
- fracture de l’humérus : 100 à 800 ml
- fracture de l’avant-bras : 100 à 400 ml
- rupture hépatique : 1500 à 2500 ml
- rupture splénique : 1500 à 2500 ml
- fracture du bassin : 500 à 5000 ml
- fracture du fémur : 300 à 2000 ml
- fracture de jambe : 100 à 1000 ml
Choc hémorragique d’origine non traumatique
- hémorragie digestive haute : varices oesophagiennes +++, ulcère gastrique avec lésion artérielle
- hémorragie digestive basse : plus rarement mais possible chez le sujet âgé, sous anticoagulants
- hémoptysie majeure
- rupture d’anévrisme de l’aorte abdominale
- hématome profond (notamment sous anticoagulants, troubles de la crase sanguine) : hématome du psoas, hématome dans une loge musculaire (cuisse), hématome des droits de l’abdomen
- rupture de grossesse extra-utérine
- complications de l’IVG, avortement, hémorragie lors de l’accouchement (placenta praevia, hémorragie de la délivrance)
- hématurie : souvent décrite dans la liste des étiologies mais peu de situations urologiques entrainent une déglobulisation importante sur saignement urogénital chez l’homme
Traitement
Hémostase immédiate
Toute hémorragie extériorisée de siège accessible doit être contrôlée immédiatement même avec des moyens rudimentaires : garrots (plutôt pneumatiques qu’élastiques, en consignant l’heure de pose), pansements compressifs, suture temporaire à points transfixiants. Les epistaxis abondants sur un traumatisme facial contre-indiquent l’usage de sonde double ballonnet (risque de fausse route), il faut se limiter à un packing antérieur et intuber si l’epistaxis est postérieur et abondant pour protéger les voies aériennes.
Le pantalon antichoc et la ceinture pelvienne visent à limiter l’hémorragie rétropéritonéale des fractures du bassin. Le pantalon antichoc est d’indication limitée aux hémorragies sous-diaphragmatiques non contrôlable par un autre moyen pour la phase préhospitalière. Il est envisageable pour les hémorragies abdominales cataclysmiques d’origine non traumatique en attente d’acheminement au bloc opératoire. Il n’est utilisable que chez le patient intubé.
La réaxation et l’immobilisation des fractures fermées ou ouvertes permet aussi de limiter les hémorragies d’origine osseuse même si le collier cervical n’a plus trop le vent en poupe. En dehors du matelas coquille, il vaut mieux éviter les attelles gonflables sur les membres.
Les sondes type Blakemore sont utilisées en cas d’hématémèse cataclysmique, ainsi que les analogues de la somatostatine. La terlipressine dans les hémoptysies massives.
Pour plus d’informations sur les moyens d’hémostase notamment en préhospitalier lire Moyens d’hémostase en préhospitalier sur le blog La Mine.
Remplissage vasculaire
L’adage classique incitant au remplissage vasculaire dit que l’hypovolémie est moins bien tolérée que l’anémie aiguë. L’auto-transfusion passive, par mise en position de Trendelenburg avec surélévation des jambes par rapport à la tête est maintenue en l’absence de traumatisme crânien grave ou de lésions du rachis ou du bassin.
Dans les premiers temps de la réanimation préhospitalière, le remplissage vasculaire massif était le traitement paraissant le plus logique pour pallier à la perte sanguine. Différents produits de remplissage existent et le soluté Ringer-lactate était celui considéré comme le plus adapté.
Une controverse a longtemps existé entre les colloïdes (HEA hydroxyethylamidons), produits permettant une restauration de pression artérielle (et donc de perfusion des organes) pour des volumes faibles comparé aux cristalloïdes qui nécessitaient l’administration de très grandes quantités de produits, mais avec un faible coût. Les solutés glucosés même enrichi, qu’on trouve en intra-hospitalier pour être isotoniques ne sont pas adaptés
Ces derniers semblent donc encore aujourd’hui préférables en première intention, au vu des effets secondaires potentiels. Les HEA ont vu leur indication restreinte aux situations de choc hémorragique où le remplissage initial par cristalloïdes ne permet pas de contrôler la situation.
En général on débute par une expansion volémique de 500 ml en 15 min (15 ml/kg chez l’enfant). Le Ringer reste malgré tout hypotonique et classiquement contre-indiqué dans les traumatismes crâniens et médullaires graves, il est préférable d’utiliser le sérum physiologique NaCl 9‰ . Si on utilise les HEA, il faut s’en tenir à 30 ml/kg de soluté perfusé, uniquement dans les 1ères 24 heures, le risque étant d’induire une insuffisance rénale et les études ayant montré (même si c’est dans le contexte du choc septique) un surplus de mortalité en réanimation au-delà d’une certaine période.
Le remplissage massif cependant n’est pas non plus dénué d’effets secondaires car il augmente le débit de saignement et donc majore la perte sanguine. Cet effet est attribué à l’élévation transitoire de TA lors de la reperfusion, mobilisant les caillots encore fragiles, phénomène auquel s’ajoute la coagulopathie de consommation initiée au niveau des lésions tissulaires. Le remplissage entraine aussi une augmentation de pression hydrostatique, de l’oedème interstitiel.
Les solutés salés hypertoniques ont été proposés dans un concept de « small volume resuscitation » et s’appuie sur l’hypotension permissive, en attente de l’hémostase définitive. Le sérum salé hypertonique crée un gradient osmotique qui entraine un transfert de liquide du secteur intracellulaire et interstitiel vers le secteur vasculaire. Cet effet est potentialisé par l’ajout d’un soluté colloïde.
Lors des études cliniques, les résultats ont été généralement bons avec amélioration de la perfusion des organes et augmentation de la performance cardiaque (peut être liée à la diminution de l’oedème myocardique). Mais en pratique les résultats restent décevants, la restauration rapide de la pression artérielle ne s’associe pas à une amélioration flagrante de la survie. L’ Hyperhes® avec du NaCl 7,5% est utilisé en perfusion rapide ne dépassant pas 250 à 500 ml.
L’hypotension permissive est supérieure dans la grande majorité des cas au remplissage massif. L’objectif d’une PA systolique à 90 mm Hg et d’une PA moyenne entre 60 et 70 mm Hg est raisonnable. Cette limite n’est pas adaptée en neurotraumatologie car l’ischémie médullaire ou encéphalique prolongée va avoir des répercussions. Dans ce cas la PAm doit se situer à 90 et la PAs à 110-120 mm Hg.
La voie d’abord pour le remplissage reste l’utilisation de plusieurs voies veineuses périphériques de gros calibre (14 à 16 G) ou la voie fémorale par desilet 8 à 10 F (sauf en cas de traumatisme de l’abdomen) ainsi que la voie intra-osseuse. Sur le très court terme, les inconvénients des 2 dernières voies sont négligeables comparés à leur facilité de mise en place. En hospitalier, un accès central par voie sous-clavière ou jugulaire sera généralement mis en place pour le monitorage.
Le débit de perfusion peut être augmenté par dispositif Blood Pump®, poches à pression pneumatique en préhospitalier et dès la phase hospitalière par des accélérateurs et réchauffeurs de perfusion électrique.
Vasopresseurs
La place des catécholamines à la phase initiale du choc hémorragique était faible voire elles étaient contre-indiquées, susceptibles d’aggraver la situation. L’absence de réponse au remplissage vasculaire (et les effets néfastes du remplissage massif) doit faire recourir aux amines vasopressives pour assurer une perfusion tissulaire correcte. L’effet recherché est principalement une vasoconstriction artérielle par effet α adrénergique, et augmentation du retour veineux par vasoconstriction veineuse. La noradrénaline paraît être l’amine de choix dans cet objectif bien que les résultats des études soient parfois contradictoires. La dopamine a de bons résultats sur le maintien de la pression artérielle mais engendre des arythmies cardiaques. Le moment de l’instauration de la noradrénaline peut être difficile, il semble raisonnable de l’utiliser après avoir tenté le recours à un remplissage vasculaire d’au moins 1500 ml. Mais il sera plus précoce si l’objectif est une normotension et non pas une hypotension permissive, de même si une induction anesthésique doit être faite pour éviter l’hypotension réactionnelle.
En gros, les amines vasopressives sont à utiliser après 15 min de remplissage bien conduit quand la PAM reste < 50 mm Hg, ou d’emblée en situation de sauvetage : noradrénaline 0,5 à 5 µg/kg/min voire adrénaline 0,5 à 5 µg/kg/min IVSE.
La surveillance étroite de la pression artérielle peut justifier la pose d’un cathéter artériel dès la phase préhospitalière si le temps de pose est < 10 min et si l’éloignement du trauma center est important, autrement ce monitorage invasif sera réalisé à la phase hospitalière.
Produits sanguins
La transfusion de culots globulaires est la base de la restauration d’une volémie avec perfusion efficace, bien que le sang ne doive pas être considéré comme un produit de remplissage.
Le seuil transfusionnel est généralement fixé entre 7 et 9 g/dl d’hémoglobine, et probablement 10 g/dl chez le patient âgé, en cas de traumatisme crânien ou chez le coronarien.
La transfusion en préhospitalier est assez rare, avec des culots globulaires O-, si l’hématocrite est < 25% ou l’hémoglobine < 8-9 g/dl. En hospitalier, en cas d’urgence vitale immédiate, elle est faite aussi par CG O-, sinon en attendant le groupage et RAI pour une transfusion isoérythrocytaire isorhésus. La commande initiale doit être de 4 CG à adapter à la réponse clinique et biologique en visant un hématocrite > 30% et hémoglobine > 10 g/dl.
L’autotransfusion des hémothorax est possible avec dispositif type cell saver ou système de recueil du sang venant du drain thoracique.
En cas de saignement massif, il faut recourir à la transfusion de plasma frais congelé à 10 à 15 ml/kg. La suite de l’administration de PFC suit généralement le nombre de CG apportés dans un rapport 1:2 ou 1:1. Les risques ne sont pas nuls (risque théorique infectieux, risque allergique, TRALI transfusion related acute lung injury). On vise un TP à 40%.
L’administration de concentrés plaquettaires se fait pour maintenir un taux de plaquettes > 50 000, et même > 100 000 chez le traumatisé crânien. La prescription initiale se fait sous forme de 4 à 8 concentrés plaquettaires ou 1 concentré plaquettaire d’aphérèse. Ou 1 unité tous les 2 à 3 unités de sang.
L’administration de concentrés de fibrinogène est probablement recommandée en cas de fibrinogénémie ≤ 1 voire 1,5 g/L pour certains auteurs, malgré les apports. Posologie 50 mg/kg.
Produits de coagulation
Le PPSB (1 ml/kg IV) est utilisé en complément de la vitamine K (10 mg IV) dans le choc hémorragique chez le patient sous antivitamines K sans attendre les résultats de l’INR.
Le facteur VII activé recombinant FVIIa est indiqué en cas de traumatisme fermé après échec du traitement conventionnel chirurgical ou interventionnel pour optimiser la coagulation : 200 µg/kg IVL.
Le Feiba®, mélange de facteurs II VII IX et X activés et non activés, utilisé dans le contrôle du saignement chez l’hémophile est à utiliser en cas de saignement majeur chez un patient sous anticoagulants oraux directs à 30- 50 U/kg, soit PPSB 50 U/kg, éventuellement renouvelés 1 fois à 8 h d’intervalle.
L’acide tranexamique Exacyl® et l’acide aminocaproïque sont des antifibrinolytiques, analogues de la lysine avec action compétitive inhibitrice de la plasmine et du plasminogène. L’acide tranexamique a prouvé un bénéfice en utilisation dans les 3 premières heures (il ne doit pas être utilisé au-delà de 3h), dans un saignement secondaire à un traumatisme sans que le risque théorique d’accident thrombo-embolique soit mis en évidence dans ce contexte. Il est utilisé à la dose de 1 g en bolus, relayé par 1 g sur 8h (il est éliminé moins de 2 h après administration). L’acide tranexamique a prouvé aussi son utilité dans les hémorragies du post-partum et doit sans doute pouvoir être utilisé dans le choc hémorragique non traumatique. C’est (hors sujet ici) un des traitements de fond dans l’angioedème à bradykinine.
Place de la desmopressine chez les patients sous antiagrégants plaquettaires avec saignement microvasculaire persistant ?
Lutte contre l’hypothermie
L’hypothermie peut être présente dès le départ du choc hémorragique, par exposition accidentelle au froid, puis secondairement par incapacité des mécanismes de thermorégulation. Elle est un facteur de mauvais pronostic chez le traumatisé. D’autres facteurs aggravent la situation : intoxication alcoolique, traumatisme crânien, nécessité d’une sédation/anesthésie, le volume administré en remplissage. La normothermie est un objectif à viser à tout prix.
Le réchauffement externe est actif : couvertures simples et de survie en préhospitalier puis couverture à air chauffé pulsé aux urgences ; ainsi qu’interne par réchauffement des solutés de perfusion notamment si remplissage et transfusion massives.
Anesthésie
L’oxygénation est primordiale puisque le choc entraine une hypoxie par absence de délivrance de l’oxygène aux tissus il faut donc l’optimiser. Chez le patient vigile, le plus simple est le masque à haute concentration en visant une SaO2 > 95%.
Chez le patient inconscient ou en choc persistant sous remplissage, il faut procéder à une intubation trachéale en induction à séquence rapide (crash induction) et une ventilation mécanique (pas de place pour la ventilation non invasive). Le patient doit être déjà perfusé en cours de remplissage pour éviter le collapsus.
Les produits utilisables pour l’induction anesthésique sont l’étomidate 0,2-0,4 mg/kg et la kétamine 0,5-2 mg/kg. Le curare à utiliser est le suxaméthonium (succinylcholine) 1 mg/kg.
Pour l’entretien de la sédation, en cas de grande instabilité, on utilisera des bolus itératifs de fentanyl 50 µg ou sufentanyl 5 µg associés à la curarisation, plutôt qu’une sédation classique par midazolam 0,05 à 0,1 mg/kg/h + fentanyl 3 à 5 µg/kg/h.
Hémostase définitive
Le conditionnement et la réanimation sont fondamentaux pour le patient en choc hémorragique mais le traitement définitif à mettre en place le plus rapidement possible est souvent une intervention chirurgicale. L’hémostase chirurgicale est parfois obtenue de manière temporaire par immobilisation des foyers de fracture (fixateur externe, pelvic clamp) plutôt que par des solutions d’ostéosynthèse définitive.
Chaque lésion majeure sera abordée par la voie correspondante : trépanation des hématomes intracrâniens, thoracotomie postérieure ou antérieure. La coelioscopie peut avoir des indications en cas de stabilisation hémodynamique mais c’est le plus souvent la laparotomie qui est plus sûre pour le bilan des lésions internes et leur stabilisation.
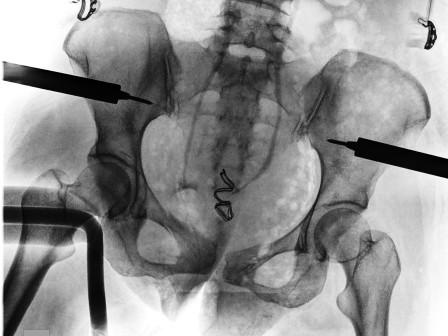
Certaines situations peuvent faire recourir aux embolisations artérielles en radiologie interventionnelle, en traumatologie pour les fractures du bassin par exemple.
Références
Médecine d’urgence préhospitalière, Collectif , Editions Médecine & Hygiène
Urgences1click, application iOS, sous la direction de Patrick Plaisance
Prise en charge des états de choc, démarche préhospitalière , Choc hémorragique traumatique , Recommandations sur la réanimation du choc hémorragique , Nouvelles recommandations concernant la transfusion 2015 , Hémorragies sévères et traitements d’exception , SFAR
Choc hémorragique , faculté de médecine de Grenoble
Polytraumatisme, Hémorragies obstétricales , présentation docstoc
Lessons in Transport – Hypotensive Resuscitation
Les transfusions massives, organistation et complications, CHRU Lille
Search results for « traumatic shock » , « hemorrhagic shock » , FOAMEM
Images library , Trauma.org
Dispositif d’autotransfusion , COPACAMU
Life-in-the-efast-lane-extended-focused-abdominal-scan-for-trauma , UKEMIG quick hits
Traumatismes graves du bassin , présentation
Code brown : combative and bleeding, Scancrit
EMCrit Podcast 30 – Hemorrhagic Shock Resuscitation , Emcrit
Serial Hemoglobin / Hematocrit – Huh? , Regions trauma pro
Médias
échographie FAST ultrasound for trauma
https://twitter.com/EM_ResUS/status/572463678823518209




 thoracotomie
thoracotomie thoracotomie
thoracotomie